Estudio de la incidencia y manejo clínico de los pacientes con metástasis cerebrales durante el año 2015 en el Hospital Universitario 12 de Octubre
Lucía Gil Abadía, Patricia Martín Alaminos, Natalia Sanz López
Trabajo fin de grado en medicina con nivel de Master, Departamento Radiología:
Servicio de Oncología Radioterápica Hospital 12 de Octubre
I. RESUMEN
Objetivos:
Realizar un estudio sobre incidencia y manejo clínico de los pacientes con metástasis cerebrales en el Hospital Universitario 12 de Octubre (HDOC) durante el año 2015.
Material y Métodos:
Se incluyeron los pacientes atendidos de metástasis cerebrales durante dicho periodo. El resumen de la información de las variables utilizadas se presentó, para aquellas que son cualitativas o no numéricas, mediante su distribución de frecuencia absoluta y porcentaje. Las variables numéricas o cuantitativas se describieron mediante medidas de tendencia central, media o mediana, acompañadas de las medidas de dispersión, desviación estándar o rango intercuartílico. Se realizó el análisis de supervivencia con el método de Kaplan-Meier.

Resultados:
Se incluyeron 106 pacientes. La incidencia de metástasis cerebrales en pacientes con cáncer fue significativamente menor que la esperada. La mediana de edad al diagnóstico fue 58 años. El 68% se diagnosticó por TAC y el tumor primario más frecuente fue de pulmón en un 47% de los casos. El porcentaje de metástasis única fue mayor que el reflejado en la literatura. Se hallaron diferencias significativas (chi cuadrado p=0.007) en cuanto al tratamiento recibido en función del número de metástasis. Se analizó la toxicidad post-radioterapia y el 59% no mostró signos de toxicidad. La media de la supervivencia global fue 11 meses.
Conclusión: Los datos obtenidos son congruentes con la literatura a nivel epidemiológico y clínico. Al ser el Servicio de Oncología Radioterápica del Hospital Universitario 12 de Octubre (SORTHU12O) centro de referencia de radiocirugía se explica la mayor proporción de metástasis única obtenida.
Palabras clave:
Metástasis cerebral; Oncología Radioterápica; Radioterapia; Sistema Nervioso Central; Incidencia; Epidemiología.
II. INTRODUCCIÓN
Las metástasis cerebrales son los tumores intracraneales más frecuentes en el adulto. La incidencia anual de las metástasis cerebrales en la población de pacientes diagnosticados de cáncer es de 4.1 a 11.1 por 100.000 habitantes1. Las metástasis cerebrales son 10 veces más frecuentes que los tumores primarios del SNC2, y entre el 10-15% de los pacientes con cáncer desarrollarán metástasis cerebrales en algún momento de su vida3, si bien este porcentaje podría ser hasta del 25%4 representando una causa importante de morbi-mortalidad. Desgraciadamente la incidencia real en la población general es desconocida.
Lo que sí se sabe es que la incidencia global de las metástasis cerebrales está aumentando por diferentes causas: el aumento de la supervivencia por mejoras en los tratamientos que concede más tiempo para el desarrollo de metástasis cerebrales, los grandes avances en las técnicas de imagen y por último, la introducción de métodos de screening en pacientes que tienen tipos de cáncer con mayor tendencia a producir metástasis cerebrales.
Según Platta la incidencia de metástasis cerebrales en EEUU en 2010 fue de 170.000 casos en una población aproximada de 308.745.538, lo que daría una incidencia de 55 pacientes por 100.000 habitantes5.
Por orden de frecuencia relativa los tumores que producen mayor porcentaje de metástasis cerebrales son: pulmón (40 - 50%), mama (15 - 25%), melanoma (5 - 20%), cáncer renal y colon (5 – 10%)6, 7.
El melanoma es el tumor con mayor tendencia a metastatizar a cerebro (en un 40-50% de los casos con un incremento adicional de un 30-40% tras autopsia)8.
La distribución de las metástasis cerebrales depende del flujo sanguíneo y normalmente viajan hasta el cerebro a través del sistema arterial. Los émbolos tumorales tienden a situarse en la unión cortico cortical del sistema arterial y en el campo vascular más distal, pues es en estas dos áreas dónde los vasos sanguíneos se estrechan hasta alcanzar un diámetro de 50 Apm. Por ello, más del 80% de las metástasis suelen ser supratentoriales, el 15% infratentoriales y el 5% se localizan en tronco cerebral9. El 78% de los pacientes presentan metástasis múltiples, el 14% metástasis solitarias y el 15% metástasis leptomeníngeas.
Los síntomas pueden aparecer antes, durante o tras el descubrimiento de la enfermedad primaria subyacente. Son producidos normalmente por el compromiso neurológico causado por el desplazamiento parenquimatoso. Suelen aparecer de una forma progresiva, pero una minoría de pacientes presenta convulsiones o síndromes tipo accidente cerebrovascular relacionados con la hemorragia intratumoral (el crecimiento acelerado en volumen por la sangre acumulada hace que estos pacientes presenten focalidad rápida). La mitad de los pacientes refiere cefalea y en la mayor parte de los casos no se va a distinguir de una cefalea tensional. La cefalea de características tumorales (que es peor por las mañanas o que despierta al paciente durante el sueño) es rara y su ausencia no impide el diagnóstico de metástasis. Otros signos y síntomas frecuentes son: hemiparesia (59%), alteración del nivel de consciencia (32%), alteraciones cognitivas (58%), debilidad focal y déficits sensitivos.
La primera prueba diagnóstica que se realiza en pacientes con sospecha de metástasis cerebral es el TAC. Se realizará RM en el caso en el que el TAC sea no diagnóstico y/o para caracterizar la lesión. Se ha demostrado que administrando triple dosis de contraste la sensibilidad de la RM aumenta significativamente sin aumentar la toxicidad, y es de vital importancia para detectar lesiones frontotemporales y/o lesiones menores de 0,5 cm de diámetro10.
Se deberá realizar biopsia de la lesión sospechosa en el caso en el no exista tumor conocido y no haya otra localización tumoral más accesible.
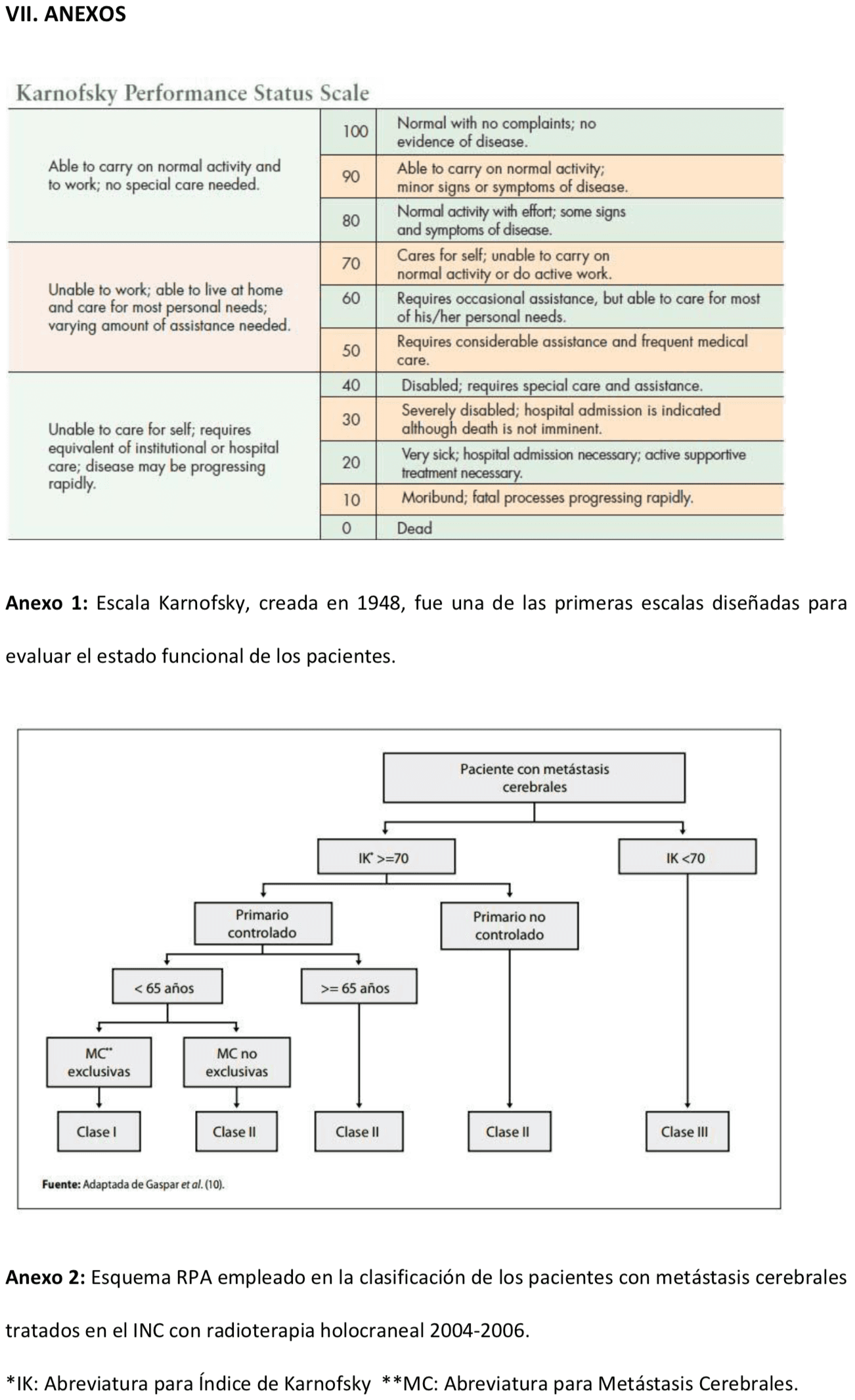
La medida del estado funcional y de la calidad de vida de los pacientes es esencial. Una de las escalas más empleadas para medir esto es la escala de Karnofsky (KPS) [Ver Anexo 1], que mide el grado de dependencia de 0 a 100, considerándose independiente una puntuación mayor de 70.
Uno de los índices pronósticos más conocidos es el RPA (Recursive Partitioning Analysis) [Ver Anexo 2], que describe tres clases pronósticas basándose en la edad, el índice de Karnofsky, el control del tumor primario y la presencia de metástasis extracraneales. Según la clasificación RPA, los pacientes pertenecientes a la clase I (Karnofsky > 70, edad < 65, tumor primario controlado y ausencia de metástasis extracraneales) son los de mejor pronóstico y con tratamientos locales pueden alcanzar supervivencias medias prolongadas de más de 7 meses. Los pacientes de la clase III (Karnofsky < 70) son los de peor pronóstico, el tratamiento suele ser paliativo con corticoides y la supervivencia media es de 1 - 3 meses. El resto de pacientes aparecen agrupados en la clase II. Las principales limitaciones de esta escala son que no valora la histología ni el número de metástasis y que la clase II es un grupo muy heterogéneo.
La limitada esperanza de vida de los pacientes se debe más a la diseminación visceral concomitante que a las propias metástasis, salvo en pacientes con melanoma metastásico, que suelen morir por progresión cerebral11. Se trata de una enfermedad compleja sin un algoritmo terapéutico único. El tratamiento médico es únicamente sintomático (corticoides y antiepilépticos), mientras que el tratamiento definitivo incluye las siguientes opciones en exclusiva y/o combinadas: cirugía, radioterapia holocraneal, radiocirugía o radioterapia estereotáxica craneal.
El SORTHU12O atiende una población de alrededor de 1.100.000 habitantes12, la mitad procedentes del área 11 y la otra mitad procedentes de áreas de influencia de la que el SORTHU12O es servicio de referencia (Tabla no 1).
El objetivo de este trabajo es determinar la casuística de metástasis cerebrales atendidas en el HDOC en el año 2015 y realizar un estudio epidemiológico y de manejo clínico de estos pacientes.
III. MATERIAL Y MÉTODOS
Se trata de un estudio analítico observacional de carácter retrospectivo sobre incidencia y manejo de pacientes atendidos de metástasis cerebrales en el HDOC en el año 2015.
Con el fin de poder llevar a cabo el presente estudio se pidió autorización al Comité de Ética e Investigación Clínica (CEIC) del HDOC y el trabajo de campo se desarrolló cumpliendo con los protocolos de acceso a los datos de los pacientes, utilizando las siguientes fuentes de información: informes de Anatomía Patológica, historias clínicas del SORTHU12O, historia clínica electrónica e informes del Servicio de Radiodiagnóstico.
Fueron criterios de inclusión el haber sido diagnosticado de metástasis cerebrales, haber recibido tratamiento o haber realizado el seguimiento de control en el HDOC durante el año 2015. Se consideraron criterios de exclusión haber padecido tumores primarios cerebrales o tumores intracraneales extraparenquimatosos. Con estos criterios se obtuvo una muestra total de 106 pacientes.
Para identificar a los pacientes diagnosticados de metástasis cerebrales en 2015 (pacientes incidentes) y a los pacientes diagnosticados con anterioridad pero que continuaban su seguimiento en 2015 (pacientes prevalentes), se obtuvieron todos los informes de RM cerebral en los que en el juicio radiológico se incluyeran las palabras "metástasis cerebral" o "metástasis cerebrales". Posteriormente se accedió a la información clínica disponible del paciente con el fin de poder estudiar 41 variables de cada sujeto, teniendo en cuenta la procedencia, si se trataba de un caso incidente o prevalente, el origen del tumor primario, sexo, edad y la situación clínica (estado
general medido por la escala de Karnofsky y RPA, número de metástasis cerebrales, si
existía tumor extracraneal activo y manejo realizado). Se analizaron también la toxicidad y las recidivas.
Para el estudio de los datos se realizó una base de datos en Microsoft Acces® y para la explotación de los mismos se utilizó el paquete estadístico SAS® (Statistical Analysis Software) en el que la información de las variables tratadas se presentó, para aquellas que son cualitativas o no numéricas, mediante su distribución de frecuencia absoluta y porcentaje. Las variables numéricas o cuantitativas se describieron mediante sus medidas de tendencia central, media o mediana, acompañadas de las medidas de dispersión, desviación estándar o rango intercuartílico. Se realizó también el análisis de la supervivencia con el método de Kaplan-Meier.
IV. RESULTADOS
Se identificaron 106 pacientes, cuya procedencia se recoge en la Tabla no 2 y de los cuales se describen las características clínicas en la Tabla no 3.
La edad media de los pacientes fue de 58 años (rango: 7-86, p50=58 SD=15). La distribución por sexos fue de 58 varones y 48 mujeres con una proporción hombre/mujer de 1,2/1. Eran de la Comunidad Autónoma de Madrid (CAM) 91 pacientes (86%). De la muestra empleada, 54 pacientes (51%) fueron incidentes, mientras que los 51 restantes (49%) fueron prevalentes. La media de metástasis cerebrales por paciente fue de 3,67 (rango 1-50, p50 = 1 y SD =7).
En 96 pacientes se pudo estudiar cuál fue la prueba de imagen diagnóstica realizada, empleándose el TAC en 29 (30%), RM en 65 (68%), PET-TAC en 2 (2%).
En 91 pacientes se pudo determinar el estado general por la escala de Karnofsky siendo de 90-100 en 15 pacientes (16%), de 70-80 en 47 (52%), de 50-60 en 24 (26%) y menor de 50 en 5 (6%).
Se pudo agrupar a 91 pacientes según la clasificación RPA de la RTOG (Radiation Therapy Oncology Group) de la siguiente manera: 19 fueron RPA clase 1 (21%), 44 RPA clase 2 (48%) y 28 RPA clase 3 (31%).
La localización de las metástasis cerebrales pudo estudiarse en 101 pacientes siendo supratentoriales en 63 casos (62%), infratentoriales en 10 (10%) y se encontraron en ambas localizaciones en 28 (28%); las metástasis en tronco se agruparon dentro de las infratentoriales.
Respecto a las características de las metástasis obtuvimos que el valor medio del radio de las metástasis fue 11.65 mm (rango 1-33mm, SD: 6.79mm); el volumen medio fue 16 cm3 (rango 0-180 cm3 y la mediana de 4.18 cm3). El número total de metástasis varió entre 1-50, siendo la mediana de 1 (SD=7.32, media= de 3.61).
Los 4 tumores primarios que produjeron con mayor frecuencia metástasis cerebrales fueron los de pulmón (47%), mama (23%), melanoma (11%) y digestivos (10%).
Según las guías de la NCCN (National Comprehensive Cancer Network)13, realizamos una clasificación de los pacientes en dos grupos en función del número de metástasis: los pacientes que tenían entre 1-3 metástasis, y los que tenían más de 3.
Pudimos estudiar el número de metástasis en 97 pacientes, obteniendo 75 con 1-3 metástasis y 22 que tenían más de 3. De los 75 pacientes con 1-3 metástasis no sabemos el tratamiento realizado en 6; mientras que del resto, el 75% recibió tratamiento con intención curativa (radiocirugía el 35%, cirugía el 28% e IMRT o RTEF el 11%) y el 19% tratamiento con intención paliativa (RT Holocraneal exclusiva 15%, y sólo el 4% recibió tratamiento médico con corticoides o quimioterapia).
De los 22 pacientes con más de 3 metástasis, en 2 casos se desconoce el tratamiento recibido, el 18% recibió tratamiento con intención curativa, el 64% de los pacientes recibió radioterapia holocraneal y el 9% tratamiento médico (corticoides y quimioterapia) ambos con intención paliativa. Estas diferencias en el tratamiento efectuado en función del número de metástasis fueron estadísticamente significativas (chi cuadrado p= 0.007).
En los 90 pacientes en los que se pudo estudiar la toxicidad de la radioterapia a los 3 meses de su finalización, se observó que no existió toxicidad alguna en 53 (59%). En 17 (19%) se observaron cambios inflamatorios-radionecrosis sin síntomas y en 20 (22%) estos cambios se acompañaron de síntomas. Evolutivamente, de los 17 pacientes en los que se observaron cambios inflamatorios-radionecrosis sin síntomas, no se administró tratamiento alguno en 6, se administraron corticoides en 3, anti-VEGF en 3, y tratamiento combinado de ambos en 4 pacientes; por último 1 paciente requirió cirugía. Sin embargo, de los 20 pacientes en los que a los 3 meses se observaron cambios inflamatorios-radionecrosis con síntomas, 2 no recibieron tratamiento alguno, 10 recibieron corticoides, 1 tratamiento exclusivo con anti-VEGF, 5 recibieron terapia combinada (anti-VEGF y corticoides) y 2 tuvieron que ser operados. La evolución de la toxicidad a largo plazo produjo discapacidad mayor en 4 pacientes (4%), con imposibilidad para cuidar de sí mismos.
En 97 pacientes se pudo estudiar el control de las metástasis cerebrales: en 45 (46%) se consiguió controlar la enfermedad, en 15 (15%) se produjo recidiva local-marginal en la zona tratada, en 12 (12%) la recaída fue a distancia de la zona tratada y en 25(26%) fue mixta. En la última revisión de los 106 pacientes, 13 estaban perdidos, 44 seguían vivos y 49 habían fallecido.
Para poder establecer una relación entre el manejo realizado en el HDOC y el resto de la Comunidad de Madrid, analizamos por separado el manejo de los pacientes del área 11. El tratamiento efectuado en los 41 incidentes y prevalentes del área 11 (Ver Tabla no 4), fue el siguiente: cirugía en 7 (17%), radiocirugía en 11 (27%), RT holocraneal (RTH) en 14 (34%), radioterapia estereotáxica (RTEF) en 2 (5%), RT volumétrica dinámica (RTVOLD) en 1 (2%), tratamiento sintomático corticoideo en 1 (2%), quimioterapia paliativa en 1 (2%) y sin tratamiento en 4 pacientes (10%).
V. DISCUSIÓN
Según las recomendaciones, la primera prueba diagnóstica que se realiza en pacientes con sospecha de metástasis es el TAC13 y la mayor parte de nuestra muestra (68%) se diagnosticó con dicha prueba.
Se demostró que el cáncer de pulmón es el principal responsable de las metástasis cerebrales, seguido en frecuencia por el cáncer de mama, melanoma y digestivo, como se refleja en la literatura6,7.
En el estudio de la localización de las lesiones se vio que siguieron la distribución descrita en estudios previos: las supratentoriales fueron las más frecuentes, seguidas de las de localización mixta (supra e infratentoriales) y, por último, las menos frecuentes fueron las infratentoriales (incluyéndose en este grupo las metástasis de tronco encefálico).
Respecto al número de metástasis, en la literatura se recoge que el 78% de los pacientes presentan metástasis múltiple y que sólo el 14% presentará metástasis única 7. En nuestro estudio los resultados muestran que el 70% de los pacientes tienen 3 o menos metástasis (siendo la moda y la mediana 1 metástasis). Lo más plausible es que exista un sesgo al ser el SORTHU12O centro de referencia en radiocirugía, lo que implica que se remitan al HDOC una gran cantidad de pacientes subsidiarios de tratamiento radical procedentes de otros centros que no dispongan de radiocirugía, mientras que aquellos no subsidiarios de tratamiento con radiocirugía recibirán radioterapia con intención paliativa en su centro de referencia.
Según las guías de la NCCN, realizamos una clasificación de los pacientes en dos grupos en función del número de metástasis.
En general, los pacientes con hasta 3 metástasis cerebrales se manejan con intención curativa mediante cirugía, radiocirugía o RTEF si se conoce el tumor primario y tienen un buen estado basal, ya que de no cumplirse se consideran de elección la radioterapia holocraneal o el tratamiento de soporte.
En el caso de los pacientes con más de 3, las guías recomiendan radioterapia holocraneal con intención paliativa. Según Yamamoto se podría emplear RTEF en pacientes con buena situación funcional y poco volumen tumoral14.
Como se ha mencionado en resultados, se encontraron diferencias significativas (chi cuadrado p= 0.007) en los tratamientos recibidos en función del número de metástasis. Por tanto, se demuestra que en el HDOC se siguen las recomendaciones de la guía NCCN, ya que el grupo formado por pacientes con 3 o menos metástasis recibió en una mayor proporción tratamientos con intención curativa; a diferencia del grupo formado por pacientes con más de 3 metástasis, que recibió en su mayoría opciones terapéuticas paliativas.
La radioterapia es efectiva para el control local de la enfermedad, y el beneficio de añadir radiocirugía como sobreimpresión tras radioterapia holocraneal ha sido demostrado en al menos dos estudios aleatorizados15,16. Llama la atención cómo todos los pacientes tratados con radiocirugía y radioterapia holocraneal recibieron esta última antes de la radiocirugía, cumpliendo las pautas demostradas en dichos estudios. Se observa que con esta pauta disminuyen las recidivas a distancia dentro del sistema nervioso central, aunque no hay repercusión en la supervivencia. Además, aumenta el riesgo de desarrollar neurotoxicidad que se manifiesta como deterioro cognitivo. Por tanto y para disminuir este efecto, se realizan en el momento actual tratamientos con radiocirugía exclusiva o con radioterapia holocraneal con preservación del hipocampo.
A partir de aquí nos centramos en el manejo de los pacientes del Área 11.
La incidencia de metástasis cerebrales es desconocida cuando revisamos la literatura, anteriormente hemos estimado la incidencia en EEUU, con las incertidumbres de si todos los casos eran incidentes o también había casos prevalentes, en cualquier caso de lo que sí podemos estar seguros es de que en el Área 11 en 2015 había 431.325 habitantes y que se atendieron 41 pacientes, siendo la incidencia-prevalencia de 9,5/100.000 habitantes. Llama la atención que áreas asistenciales bien definidas en las que existen servicios de oncología médica, como el Área 9 (Leganés) y el Área 10 (Getafe); la primera con una población de 189.219 y la segunda con 215.334, sólo nos envíen para valoración de radioterapia 12 y 9 pacientes respectivamente. Esto resulta especialmente llamativo en el área sanitaria 10 en la que además de Oncología Médica
disponen de servicio de Neurocirugía. Sospechamos que existen pacientes que no están siendo derivados adecuadamente.
Si extrapolamos la incidencia-prevalencia de metástasis cerebrales del Área 11 (41 pacientes en un área de 431.345 habitantes) a la población de Madrid en el año 2015 (6.402.162), deberían haberse atendido 609 pacientes con metástasis cerebrales.
De los 41 pacientes del área 11 se utilizó tratamiento radioterápico con intención radical en 14 (34%). Teniendo en cuenta los datos del SIAE (Sistemas de Información de Atención Especializada) en el epígrafe de radiocirugía cerebral y/o radioterapia estereotáxica fraccionada cerebral, se contabilizaron 215 pacientes de la CAM tratados con tratamiento radical. Esto representaría un 35% de los 609 pacientes teóricos, demostrándose así una equivalencia en el porcentaje de pacientes tratados de manera radical en el HDOC y la CAM.
Estudiar la supervivencia no era el objetivo del trabajo, sin embargo, nos gustaría hacer mención a algunos de los aspectos más importantes relacionados con la misma. Los resultados se han obtenido a partir de una muestra n=54 constituida únicamente por los pacientes incidentes. No se han incluido los prevalentes porque de haberlo hecho se habría cometido un sesgo importante al no considerar todos aquellos pacientes que se diagnosticaron de metástasis cerebrales y que fallecieron antes del 2015.
Se ha construido una curva de supervivencia con el método Kaplan-Meier de la supervivencia global de los 54 pacientes incidentes, en la que se ve que a 2 años el 39% de los pacientes están vivos. (Ver Figura 1).
Con respecto al estado funcional de los pacientes incidentes existió una tendencia a la significación (Log-Rank p=0,098) en la que los pacientes con mejor Karnofsky (KE>70%) tendían a una mayor supervivencia que los pacientes con peor estado funcional (KE<70%).
En cuanto al RPA al diagnóstico de los pacientes incidentes no existieron diferencias significativas (Log-Rank p=0,17) pero sí se apreció una tendencia hacia una supervivencia mayor en pacientes con RPA 1 y 2 que en aquellos con RPA 3.
VI. CONCLUSIONES
1. Los datos obtenidos respecto al tumor primario son congruentes con los encontrados en la literatura. Los tumores primarios responsables de la mayor parte de las metástasis cerebrales fueron: cáncer de pulmón (47%), mama (23%), melanoma (10%) y digestivo (9%).
2. Los datos obtenidos respecto a la localización de las metástasis también se corresponden con los encontrados en la literatura. En orden descendente de frecuencia se encontraron las metástasis supratentoriales, las metástasis a ambos niveles y por último las infratentoriales.
3. En cuanto al número de metástasis llama la atención que más de la mitad de nuestra muestra presentó metástasis única frente al 14% reflejado en la literatura. Esto es debido a que el SORTHU12O es centro de referencia en radiocirugía, por lo que se remiten a este hospital los pacientes con metástasis única subsidiarios de tratamiento curativo.
4. En diversos estudios se ha visto que la media de la supervivencia global es menor de 1 año17. Estos datos concuerdan con los 11 meses de media de supervivencia global obtenidos en nuestro estudio.
5. Pensamos que los datos de incidencia están por debajo de los reales. Lo más probable es que haya muchos pacientes que no estén recibiendo el tratamiento adecuado porque no existen servicios de Neurocirugía y Radioterapia con recursos y medios suficientes.




VIII. AGRADECIMIENTOS
Nuestro más sincero agradecimiento al Dr. Pérez-Regadera por la tutorización del trabajo; a D. David Lora Pablos por el tratamiento informático de los datos y a la Dra. Ana Ramos y al Dr. Aurelio Hernández por facilitarnos los informes de Radiodiagnóstico y Anatomía Patológica respectivamente, utilizados para la realización de la base de datos.
IX. BIBLIOGRAFÍA
-----------------------------------------
1 Nelson JS, von Deimling A, Petersen I, Janzer R-C. Metastatic tumours of the CNS. In: Kleihues P, Cavenee WK, editors. Pathology and genetics of tumours of the nervous system. World Health Organization classification of tumours. Lyon: IARC Press; 2000. p. 250-3
2Sawaya R, Ligon BL, Bindal RK. Management of metastatic brain tumors. Ann Surg Oncol 1994;1:169- 178
3 Wen PY, Loeffler JS. Management of Brain Metastases. Oncology (Huntingt) 1999;13:941-57
4 Wen PY, Black PM, Loeffler JS. Metastatic Brain Cancer. In: DeVita V, Hellman S, Rosenberg SA, eds. Cancer: Principles and Practice of Oncology. Vol. 2. 6th ed. Philadelphia, PA: Lippincott, WIlliams, & Wilkins; 2001:2655–2670
5 Platta CS, Khuntia D, Mehta MP, Suh JH. Current treatment strategies for brain metastasis and complications from therapeutic techniques: a review of current literature. Am J Clin Oncol. 2010 Aug;33(4):398-407. doi: 10.1097/COC.0b013e318194f744. Review. PubMed PMID: 19675447.
6 Barnholtz-Sloan JS, et al. Incidence proportions of brain metastases in patients diagnosed (1973 to 2001) in the Metropolitan Detroit Cancer Surveillance System. J Clin Oncol. 2004;22:2865–2872.
7 Schouten LJ, Rutten J, Huveneers HA, Twijnstra A. Incidence of brain metastases in a cohort of patients with carcinoma of the breast, colon, kidney, and lung and melanoma. Cancer. 2002;94:2698–2705.
8 Douglas JG, Margolin K. The treatment of brain metastases from malignant melanoma. Semin Oncol. 2002;29(5):518-524.http://www.ncbi.nlm.nih.gov/pubmed/12407517. Accessed May4, 2016.
9 Delattre JY, Krol G, Thaler HT, Posner JB. Distribution of brain metastases. Arch Neurol. 1988;45:741– 744.
10 DeVita, Vincent T. ; Lawrence, Theodore S. ; Rosenberg, Steven A. Devita Hellman & Rosenberg’s Cancer: Principles & Practice of Oncology. 8a Edición. Editorial Lippincott Williams & Wilkins. 2008. Volumen II, Parte 3, Capítulo 60.
11 Ba JL, Jandial R, Nesbit A, Badie B, Chen M. Current andemerging treatments for brain metastases. Oncology (WillistonPark). 2015;29(4):250-257.http://www.ncbi.nlm.nih.gov/pubmed/25952487. Accessed April11, 2016.
12 Memoria 2015 Hospital Universitario 12 de Octubre. Madrid. España.
13 https://www.nccn.org/professionals/physician_gls/f_guidelines_nojava.asp
14 Yamamoto, M., Serizawa, T., Shuto, T., Akabane, A., Higuchi, Y., Kawagishi, J., ... & Nagano, O. (2014). Stereotactic radiosurgery for patients with multiple brain metastases (JLGK0901): a multi-institutional prospective observational study. The Lancet Oncology, 15(4), 387-395.
15 Andrews DW, Scott CB, Sperduto PW, et al. Whole brainradiation therapy with or without stereotactic radiosurgery boost for patients with one to three brain metastases: phase III resultsof the RTOG9508 randomised trial. Lancet. 2004;363(9422):1665-1672.doi:10.1016/S0140-6736(04)16250-8.
16 Kondziolka D, Patel A, Lunsford LD, Kassam A, Flickinger JC.Stereotactic radiosurgery plus whole brain radiotherapy versusradiotherapy alone for patients with multiple brain metastases.Int J Radiat Oncol Biol Phys. 1999;45(2):427-434.http://www.ncbi.nlm.nih.gov/pubmed/10487566. Accessed June3, 2016.
17 Barnholtz-Sloan JS, Yu C, Sloan AE, et al. A nomogram for individualized estimation of survival among patients with brain metastasis. Neuro Oncol. 2012;14(7):910-918. doi:10.1093/neuonc/nos087.



